ضمور العضلات الشوكي، مرض يجعلنا نتساءل لماذا هناك مرضى تتبنّى حكوماتهم تكاليف العلاج الباهضة بينما لا يتسنّى لأطفال آخرين ذلك؟ لماذا لا تتبنّى المؤسسات الخيرية العالمية تكاليف علاج الأطفال المصابين؟ وهل ما زالت مجتمعاتنا متكافلة قادرة على ستر عجز مؤسساتنا الصحية عن إغاثة السقيم؟
للوقوف على حجم المشكلة، سنتعرّف إلى ماهية المرض والأعراض التي تظهر بها، إضافة إلى آليات التشخيص وطُرق العلاج وما ننتظره في المستقبل.
ماذا يعني ضمور العضلات الشوكي؟
باختصار ضمور العضلات الشوكي (SMA) هو حالة وراثية خطيرة ونادرة تجعل العضلات تضعف وتزداد سوءًا بمرور الوقت، يؤثّر هذا الاضطراب على الخلايا العصبية الحركية الواقعة في الحبل الشوكي، المسؤولة بدورها عن حركة العضلات الإرادية، عندما تُصاب هذه الخلايا تصبح عديمة الاستجابة، ما يعني غياب الإيعاز العصبي الذي يأمر العضلة بالحركة، بالتالي تُصاب العضلات نتيجة انعدام الحركة بالضعف والتقلص والضمور.
غالبًا ما يصيب الضمور العضلي الشوكي الرضّع والأطفال، ويصيب البالغين بنسب أقل ويجعل من الصعب عليهم استخدام عضلاتهم، وتظهر عدد من الأعراض أبرزها ضعف الذراعَين والساقَين وصعوبة الجلوس والزحف والمشي ورعشة العضلات، ومشاكل في العظام والمفاصل، وانحناء العمود الفقري، وفي الحالات المتقدمة تظهر مشاكل في البلع وصعوبات في التنفُّس.
يتمّ التشخيص عن طريق إجراء عدد من الفحوص الطبية، منها عيّنات دم لغرض إجراء الفحص الجيني، نسبة الكرياتين كيناز (CK) في الدم، فحص مخطط كهربائية العضل (EMG)، التصوير بالرنين المغناطيسي، أو قد يتمّ أخذ خزعة من نسيج العضل.
الأشخاص المصابون بالضمور العضلي الشوكي يكونون إما فاقدين لجزء من جين SMN1 وإما لديهم جين متغيّر
كيف تحدث الإصابة؟
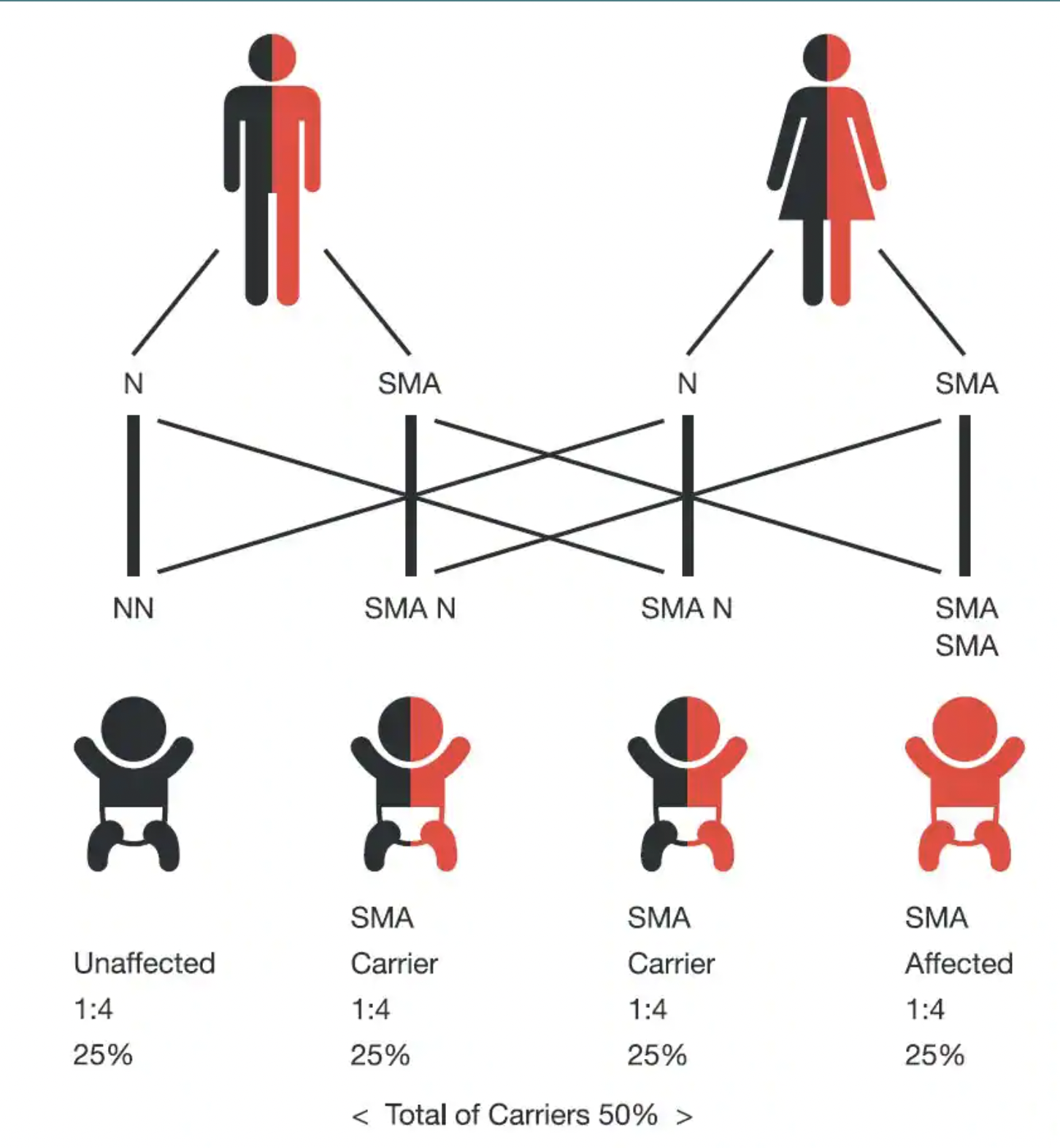
ضمور العضلات الشوكي ليس بالمرض الشائع، حيث يصيب طفلًا واحدًا من بين 8 آلاف ولادة، وتخضع الإصابة بالمرض لقوانين الوراثة المتنحية، لا يمكن أن يولد الطفل مصابًا بالضمور العضلي الشوكي إلا إذا كان لدى كلا الوالدَين جين معيب يسبّب المرض، أي بمعنى أن الطفل كي يكون مصابًا بالمرض يجب أن يرث نسختَين من الجين المتحور أو المعاب.
الأشخاص المصابون بالضمور العضلي الشوكي يكونون إما فاقدين لجزء من جين SMN1 وإما لديهم جين متغيّر (متحوّر)، ينتج جين SMN1 السليم وجينات SMN2 بروتين SMN، الذي تحتاجه الخلايا العصبية الحركية للبقاء على قيد الحياة والعمل بشكل صحيح، حيث لا ينتج الأشخاص المصابون بالضمور العضلي الشوكي ما يكفي من بروتين SMN، وبالتالي تتقلص الخلايا العصبية الحركية وتموت.
إن العائلة التي تنجب طفلًا مصابًا بضمور العضلات الشوكي، هناك احتمالية 25% أن تنجب طفلًا آخر مريضًا بضمور العضلات الشوكي، واحتمال 50% أن يكون طفلهم حاملاً للمرض لكن غير مصاب بالضمور العضلي الشوكي، واحتمال 25% أن يكون الطفل سليمًا غير مصاب وغير ناقل للجين المصاب.
أنواع SMA
بالنسبة إلى الأطفال والبالغين، تختلف شدة المرض من شخص إلى آخر، ويتأثر كل طفل وبالغ بشكل مختلف، ولكل مريض تجربة خاصة مع المرض، أما الأنواع فتصنَّف كالتالي:
النوع 0
الأندر والأشد خطرًا، يظهر خلال العمر الجنيني ويتطور أثناء الحمل، يتحرك الجنين المصاب بشكل قليل في الرحم، ويولد بمشاكل في المفاصل وضعف العضلات وصعوبات في التنفس، غالبًا ما يفارق الحياة قبل الشهر السادس من عمره.
النوع 1
النوع الطفولي، ويُسمّى أيضًا مرض Werdnig-Hoffman، أو ما يطلَق عليهم غير الجالسين (Non-sitters)، يصيب الأطفال خلال الأشهر الستة الأولى من حياتهم، لا يتمكّن الطفل المصاب من دعم رأسه أو الجلوس دون مساعدة، والخوف الأكبر هو تدهور الحالة بضعف العضلات التي تتحكم في التنفُّس، ما يؤدّي إلى موت الأطفال المصابين قبل إكمالهم العام الثاني.
النوع 2
النوع الطفولي المزمن أو Dubowitz disease، حيث تبدأ الأعراض عادة بين الشهر 7 و18 من العمر، يصيب الطرفَين السفليَّين في الغالب، حيث يستطيع الأطفال الجلوس لكن يصعب عليهم الوقوف دون دعم، لذلك يُطلق عليهم الجالسين (Sitters).
كما أن عضلات التنفس والبلع ممكن أن تتأثر، ما يجعل المصاب أكثر عرضة لالتهابات الصدر، ومضاعفاته تؤثر على متوسط العمر المتوقع (قد يصلون عمر البلوغ).
النوع 3
النوع الثالث هو الحالة الطفيفة من المرض، ويُسمّى أيضًا Kugelbert-Welander، تبدأ الأعراض بالظهور بين الأعوام 2 و17 على شكل صعوبة في المشي والتهابات الجهاز التنفسي المتكررة، ممكن أن تسوء الأعراض بالتدريج مؤثرةً على قدرة المشي والجري وصعود السلَّم أو النهوض من الكرسي، ولا يؤثر هذا النوع على العمر المتوقع.
النوع 4
أو النوع الذي يصيب البالغين، يظهر عند البلوغ ونادرًا ما يؤثر على التنفس والبلع أو يتطور إلى حالة شديدة، يتقدم المرض ببطء مع مرور الوقت، ما يجعل المريض يعاني من صعوبات في حياته اليومية، كالمشي والاستحمام وارتداء الملابس، لكن لا يؤثر على العمر المتوقع للمريض.
هل هناك علاج لضمور العضلات الشوكي؟
للأسف لا يوجد علاج شافٍ إلى يومنا هذا، لكن يعوّل الباحثون على تطوير العديد من خيارات العلاج، خصوصًا بعد معرفة العلماء الجين المسؤول عن الإصابة.
حاليًّا منحت إدارة الغذاء والدواء الأمريكية (FDA) الموافقة على استخدام 3 عقارات بيولوجية، هي Zolgensma وNusinersen وRisdiplam.
نوسينرسن (Spinraza®)
أول علاج دوائي معتمَد دوليًّا لـ SMA، تمّت الموافقة عليه من قِبل إدارة الأغذية والعقاقير (FDA) عام 2016، وهو أليغنوكليوتيد اصطناعي مضادّ للحساسية (قطعة صغيرة من مادة وراثية من صنع الإنسان)، يستهدف الجين المصاب ويحفّز إنتاج بروتين SMN.
يُعطى العلاج للأطفال من عمر 2 إلى 12 سنة عن طريق إبرة تُحقن عبر السائل الموجود في الحبل الشوكي، بشكل 4 جرعات أولية (بفارق 14 يومًا بين جرعة وأخرى) ثم يليها جرعة كل 4 أشهر، ويستمر العلاج مدى الحياة، أما عن الفترة التي يستغرقها المريض حتى تظهر الاستجابة والتحسُّن فتختلف من مريض إلى آخر، ممكن من بضعة أشهر إلى عام.
تكلفة Spinraza ما بين 625 ألف دولار و750 ألف دولار في السنة الأولى، ثم حوالي 375 ألف دولار كل عام بعد ذلك.
ريسديبلام (evrysdi®)
أول علاج دوائي يؤخَذ عن طريق الفم لعلاج ضمور العضلات الشوكي للأطفال والبالغين، تمّت الموافقة عليه من قِبل إدارة الأغذية والعقاقير (FDA) عام 2020 للاستخدام من عمر شهرَين فما فوق.
يعمل هذا العلاج على منع جينات SMN2 من تعطيل إنتاج البروتين، يؤخَذ العلاج مرة واحدة في اليوم وتظهر التجارب السريرية تحسُّنًا في وظيفة العضلات بعد 12 شهرًا لدى 41% ممن تناولوها.
مؤخّرًا تمَّ نشر وتوثيق إشارات أمان جديدة متعلقة بـ Evrysdi risdiplam في ألمانيا في مجلة “أورفانيت” للأمراض النادرة، حيث تمَّ علاج أكثر من 100 شخص بالعلاج عن طريق الفم، وتكلفة Evrysdi السنوية كحدٍّ أعلى 340 ألف دولار.
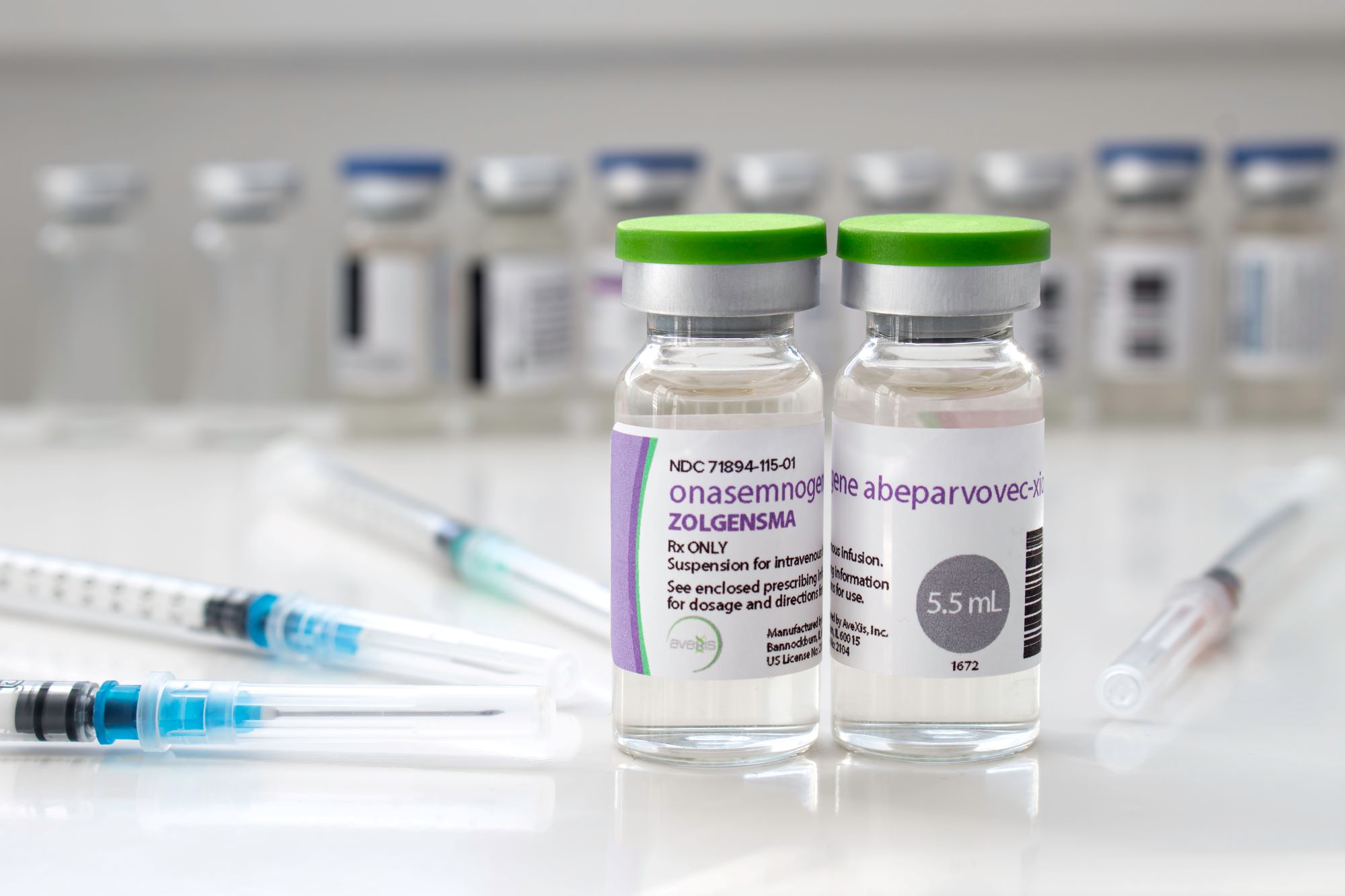
onasemnogene Zolgensma®
العلاج الثوري وأغلى عقار بالعالم بكلفة 2.1 مليون دولار، يقوم هذا العلاج باستبدال الجين SMN1 المعاب أو المفقود بآخر فعّال، ويُعطى للأطفال لمرة واحدة عن طريق الوريد.
علاجات واعدة
Taldefgrobep هو علاج تجريبي يستهدف العضلات، حيث تمَّ البدء بالمرحلة الثالثة من التجارب السريرية، ومن المتوقع أن يعالج هذا الدواء الضعف المتبقي والعيوب الوظيفية لدى مرضى ضمور العضلات الشوكي.
بالإضافة إلى العلاج الدوائي، فإن ممرضي ضمور العضلات الشوكي فريق طبي مكوَّن من أطباء متخصصين في عدة مجالات، مثل أطباء الأعصاب، أطباء العظمية، أطباء الجهاز الهضمي والتنفسي والمعالجين الفيزيائيين.
يقترح فريق الأطباء إلى جانب العلاج الدوائي بعض الطرق الأخرى للمساعدة في إدارة الأعراض، مثل تمارين التنفس والبلع، أيضًا العلاج الطبيعي الذي يشمل تمارين وأنشطة يومية منتظمة لحماية مفاصل المريض والحفاظ على قوة العضلات.
هل تكلفة Zolgensma معقولة؟
من المعلوم أن العلاجات الجينية ذات ثمن باهظ، ويرجع السبب إلى كلفة الأبحاث وتكاليف التصنيع الدقيقة، لكن هل مبلغ 2.1 مليون دولار أمريكي سعر منطقي؟
يُثار الجدل كثيرًا حول ثمن هذا العلاج، ودفاع شركة نوفارتيس (Novartis) على استحقاق العلاج لهذا المبلغ، وأن العلاج يُعطى لمرة واحدة على خلاف العلاجَين الآخرَين، إذ تكون تكلفة Spinraza لكل 10 سنوات حوالي 4 ملايين دولار، بالإضافة إلى أنه يحتاج جرعات متعددة لمدى الحياة.
ترفض شركة نوفارتس الإفصاح عن الرقم الحقيقي لتكلفة العلاج، وتجادل بأن كلفة العلاج لا شيء أمام فعالية العلاج وعدد السنوات التي سوف يعيشها المريض بعد استخدام الدواء، كما تضيف الشركة أنها دفعت مبلغ 8.7 مليارات دولار حتى تستحوذ على شركة AveXis المطوِّرة لعقار Zolgensma، وأن إجبار شركات الأدوية على جعل العلاج أرخص يعني إيقاف تطوير علاجات جديدة في المستقبل.
يقول مايك فريزر، المدير العام في شركة Novartis Gene Therapies: “علينا أن ننظر إلى التكلفة على مدى الحياة. يقول الناس إن منتجًا مثل Zolgensma مكلف للغاية. ولكن إذا نظرت إلى عقاقير أخرى، مثل علاج الأورام، على مدار حياتك، سترى أنها أغلى بكثير. نعتقد أنه سعر عادل للغاية ويعتمد على القيمة”.
يمكن إجراء فحص للجنين أثناء فترة الحمل في حال وجود طفل سابق في العائلة مصاب بضمور العضلات الشوكي
فبحسب دراسة نُشرت في مجلة Health Economics لإنشاء عقار جديد، فإن الأمر يتطلب في المتوسط 2.6 مليار دولار على مدار أكثر من 10 سنوات من التجارب والأبحاث، والتي قد ينتهي قسم كبير منها بالفشل (14% فقط من الأدوية في التجارب السريرية تحصل في النهاية على موافقة إدارة الغذاء والدواء)، ومن هذا المنظور ممكن أن نعتبر أن شركات الأدوية المصنّعة تعتمد على هذه الأدوية القليلة الناجحة، وترفع سعرها بشكل كبير لاسترداد ما تمَّ صرفه لتمويل الأبحاث لاحقًا.
النقد الآخر الذي طال شركة نوفارتس فيما يخصّ علاج Zolgensma هو تقديمها خصومات كبيرة على سعر العلاج للحكومات التي توفر العقار لمرضاها، بينما تبيع العقار دون خصم وبشكل فردي للمرضى الذين يحتاجونه في بلدان العالم الأخرى.
بمعنى أن الطفل المصاب في بلد مثل بريطانيا يحصل على العلاج بالمجّان، وستدفع حكومة بلده مبلغًا أقل من سعر العلاج، ربما 1.7 مليون دولار أو أقل، بينما طفل آخر في الهند أو مصر مثلًا سيضطر إلى دفع مبلغ العلاج كاملًا 2.1 مليون دولار دون أي خصم أو دعم حكومي.
وكمحاولة من شركة نوفارتس للتعامل مع الوصول العالمي، التزمت منذ عام 2020 بتقديم علاج مجاني لـ 100 طفل كل عام في البلدان التي لا توفِّر حكوماتها نفقة العلاج، عن طريق سحب الأسماء على غرار اليانصيب، هذه المبادرة التي لاقت الانتقاد اللاذع لمدى أخلاقية هذه المبادرة، وتمَّ تشبيهها بفيلم “ألعاب الجوع (Hunger Games)” الشهير، وكان ردّ الشركة بأنه “الطريقة الأكثر عدلًا” لتخصيص الجرعات المجانية.
وأخيرًا، لا بدَّ من الوقوف أمام التحديات التي تواجه أهالي الأطفال المصابين، منها التأخُّر في تشخيص المرض حتى تبدأ الأعراض السريرية الخطيرة بالظهور، والتي عندها سيفقد الطفل العديد من الأعصاب الحركية، حيث يعتقد بعض العلماء أن إعطاء العلاج مبكّرًا عند الولادة أو قبل ظهور الأعراض يمكن أن تقترب نتائجه من الشفاء، لكن كلّما تقدم الطفل في السن كلّما قلّت فعالية العلاج.
وللتغلب على هذه المشكلة، ألزمت العديد من البلدان، كالولايات المتحدة وألمانيا وبولندا وبلجيكا وأستراليا وفي بعض أجزاء اليابان، الفحص الروتيني عند الولادة للكشف عن SMA، ويتمّ إجراء هذا الفحص عن طريق أخذ عيّنة دم من كعب قدم الطفل حديث الولادة. كما يمكن إجراء فحص للجنين أثناء فترة الحمل في حال وجود طفل سابق في العائلة مصاب بضمور العضلات الشوكي، أو إذا كان الوالدان على معرفة بأنهما حاملان للمرض.
التحدي الآخر، وهو الأصعب، هو كلفة العلاج، حيث توفِّر بعض البلدان المتقدمة العلاج بالمجّان لمرضى ضمور العضلات الشوكي، وبعض بلدان العالم العربي مثل قطر، أما بقية بلدان العالم الثالث فلا تمدّ يد العون لهؤلاء المرضى، وتغصّ منصات التواصل الاجتماعي بحملات يائسة لجمع التبرعات ومناشدات الأهالي للشيوخ والحكّام كمحاولة لإنقاذ الأطفال المصابين، والحل بتبنّي الحكومات والمؤسسات الخيرية العالمية تكاليف العلاج.