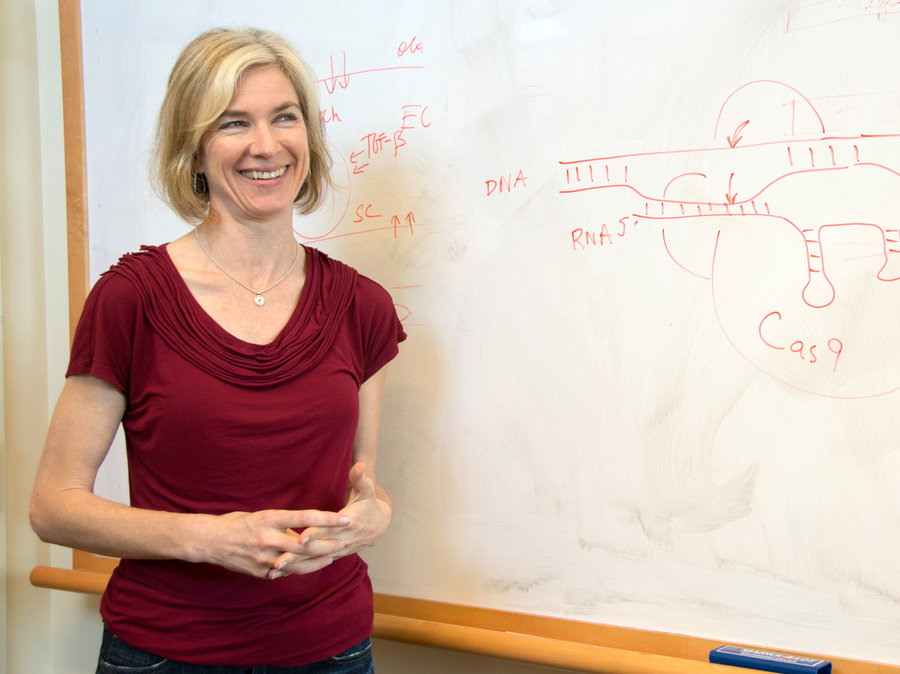ستيفاني تيليكس وروبوتات باكستر
كانت إحدى أكثر القصص المثيرة لهذا العام هي قصة ابتكار الروبوت (baxter)، وهو روبوت يمكنه تعلم كيفية التقاط الأشياء غير المألوفة وكيفية التنقل في أماكن غير مألوفة من خلال عدد من الكاميرات وأجهزة الاستشعار بالأشعة تحت الحمراء، مما يتيح له إمكانية تحليل الوضع من زوايا مختلفة، هذه العملية عادة ما تتطلب الكثير من المحاولات، وأحيانًا تستغرق العديد من الساعات، ولكن بمجرد أن يتعلم أحد روبوتات (baxter) شيئًا ما، يصبح بإمكانه “تعليم” الروبوتات الأخرى التي تمتلك ذات أجهزة الاستشعار والقوابض ذاك الأمر الذي تعلمه، من خلال قيامه بترميز المعلومات بشكل يمكّنه من تحميلها على أنظمة الروبوتات الأخرى.
تم تصميم باكستر من قِبل “ستيفاني تيليكس”، وهي أستاذة مساعدة في قسم علوم الحاسوب في جامعة براون، والتي تقول بأن هدفها هو “بناء روبوتات يمكنها بسهولة استخدام اللغة الطبيعية للتواصل مع البشر”.
تبعًا لتيليكس، بعد 20 عامًا، سيمتلك كل منزل روبوت شخصي يمكنه أن يؤدي المهام الروتينية مثل تنظيف مائدة العشاء وغسل الملابس وإعداد العشاء، ولكن لتحقيق هذا الهدف من الضروري أن تتجاوز الروبوتات مجرد التفاعل مع الأشخاص وتستطيع أيضًا التعاون معهم.
تضيف تيليكس، بأنه عندما تصبح هذه الأجهزة أكثر قوة وأكثر قدرة على التحكم الذاتي، سيصبح من المهم تطوير أساليب تمكن الأشخاص من إخبارها بما يجب عليها القيام به، وما نحاول القيام به هنا هو إيجاد طريقة تمكن روبوتات من التلاعب وفهم الكائنات في بيئتها مما يمكنها بالنتيجة من أن تكون متعاونة إلى أقصى الدرجات مع البشر.
ميليسا ليتل وصناعة الكلى
كانت “ميليسا ليتل”، وهي رئيسة مختبر أبحاث الكلى في ملبورن، مسؤولة هذا العام عن تطوير كلى صغيرة من الخلايا الجذعية، وقد استطاعت هذه الكلى، على عكس التجارب المماثلة السابقة، احتواء جميع أنواع الخلايا التي توجد عادة في الكلى البشرية، والنجاح في تأدية وظيفتين رئيسيتين، وهما الحفاظ على توازن السوائل في الجسم وتصفية الدم.
هذه العملية، التي تم القيام بها تحت إشراف الفريق، كانت مماثلة لتطور الجنين من المضغة، وعلى الرغم من أن الكلى ليست مجهزة ليتم زراعتها في البشر حتى الآن، إلّا أنها سوف تستخدم لنمذجة الأمراض والعلاج بالخلايا، وسوف تكون جزءًا حيويًا في مجال تطوير تكوين الأعضاء البشرية في المختبر، كما سيتم استخدامها لفحص الأدوية المستخدمة لعلاج أمراض الكلى.
تبعًا لليتل فإن الكلى المصغرة معقدة للغاية وهي حقيقية أكثر من أي وقت مضى، إنها مهمة لاختبار الأدوية، وتفتح الباب أيضًا أمام علاج الخلايا والهندسة الحيوية لاستبدال الكلى، وقد يعني هذا إيجاد علاجات جديدة لمرضى الفشل الكلوي يومًا ما.
جنيفر دودنا والكريسبر
كان الخبر الأكثر هيمنة على عناوين الصحف لهذا العام هو الكريسبر (CRISPR)، وهو تكنولوجيا لتعديل الجينات، حيث وُصف الكريسبر على أنه “عامل يمكن أن يحدث تغييرات كبيرة في المجال الطبي”، وبأنه “عامل مخلخل” في الطب الحيوي، أما جنيفر دودنا، والتي كانت أول من اكتشاف هذه التقنية، فقد وصفت بأنها “رائدة” في هذا المجال.
يعتبر الكريسبر أداة تعديل الجينوم الأكثر دقة وكفاءة ومرونة من بين جميع التكنولوجيا التي كانت موجودة في السابق، فمن خلال سماحه للعلماء بشكل أساسي بأن يقوموا بـ “قص ولصق” قطعة من تسلسل الحمض النووي في الجينوم، استطاع الكريسبر أن يحوّل أنزيمات (CAS-9) إلى مهندسين دقيقين، ومطابقة الحمض النووي في خلايا معينة، والقيام إما بقطعها أو إصلاحها.
حتى الآن، منع الكريسبر تطور فيروس نقص المناعة البشرية في الخلايا البشرية، وعكس الطفرات التي تسبب العمى، وأوقف الخلايا السرطانية من التكاثر وأكثر من ذلك، وهذه التقنية لا يتم استخدامها فقط لدى البشر، حيث إن المهندسين الحيويين يمكنهم استخدام الكريسبر أيضًا لتغيير المواد النباتية، ويمكن للمهندسين الزراعيين استخدامها لحماية المحاصيل من الفيروسات.
ماريا بيريرا واللاصق الحيوي
تعتبر عيوب القلب الخلقية من الأمراض الشائعة جدًا لدى الأطفال، وهي من العيوب الخلقية المصنفة في المرتبة الأولى في المملكة المتحدة، حيث تؤثر على حوالي 8 ولادات من كل 1000 ولادة، وتبعًا لكون قلوب الأطفال صغيرة جدًا، فإن عملية خياطة النسيج قد تكون خطيرة للغاية عليها، ويمكن أن يكون من الصعب منع حدوث المزيد من الضرر لقلوب هؤلاء الأطفال الضعيفة أساسًا.
هنا تدخلت “ماريا بيريرا”، وهي رئيسة الأبحاث في مركز جيكو للطب الحيوي، حيث أرادت أن تطور لاصق من شأنه أن يحل محل الغرز، يكون بمقدوره البقاء ضمن الظروف القاسية للقلب، وهو بذات الوقت أقل قساوة بكثير من العمليات الجراحية التقليدية التي يتم إجراؤها للقلب.
كان اللاصق التي استطاعت بيريرا تطويره يغطي كل هذه المعايير، فهو قابل للتحلل، ولا يشكل خطرًا على الأنسجة البشرية، كما أنه لين ومرن وديناميكي مثل الأنسجة البشرية، لذلك فهو قادر على الصمود في وجه جميع العمليات الحيوية للجسم، كما أن هذا الغراء لا يلتصق سوى عند تسليط الأشعة فوق البنفسجية عليه، وهذا يعني أن الجراحين سيمتلكون السيطرة الكاملة عليه خلال العمليات جراحية لتصحيح الثقوب في القلب، ومن المتوقع أن يتم البدء باستخدامه على نطاق واسع في أوائل عام 2017.